Generell kjemi omfatter grunnleggende kjemi.
I dette emnet vi du blant annet lære stoffers oppbygning og egenskaper, reaksjoner og hvordan de fremstilles. Du vil også få erfaring fra lab.
General Chemistry: The Basics
Forfatter: Alfred A. Christy
Utgiver: McGraw-Hill Education
Utgivelsessted: USA
Årstall: 2020
Utgave: Custom edition
Sideantall: 412
Periodesystemet
Molkonseptet
Elektronegativitetsskala
| Forskjell i negativitet | 0 – 0,4 | 0,4 – 1,7 | 1,7 → |
| Bindingstype | Ikke polar | Polar kovalent | Ionebinding |
| Fordeling | Like fordelt | Skjevt fordelt | Elektronovergang |
Finn Massen
| A | = | Z | + | N |
| Massetall | Atomnummer | Antall nøytroner |
Prefisk for Binære molekylære frobindelser
| Prefiks | Antall |
|---|---|
| Mono- | 1 |
| Di- | 2 |
| Tri- | 3 |
| Tetra- | 4 |
| Penta- | 5 |
| Heksa- | 6 |
| Hepta- | 7 |
| Okta- | 8 |
| Nona- | 9 |
| Deca- | 10 |
Elektronkonfigurasjon (forenklet versjon)
Viktige syrer med tilhørende salter
| Syre | Syrerest | Salt | |
| Formel | Navn | ||
| H2SO4 | Svovelsyre | SO42- | Sulfat |
| HNO3 | Salpetersyre | NO3- | Nitrat |
| H2CO3 | Karbonsyre | CO32- | Karbonat |
| H3PO4 | Fosforsyre | PO43- | Fosfat |
| HClO3 | Klorsyre | ClO3- | Klorat |
| H3BO3 | Borsyre | BO33- | Borat |
Syrlinger
| Syre | Syrerest | Salt | |
| Formel | Navn | ||
| H2SO3 | Svovelsyre | SO32- | Sulfitt |
| HNO2 | Salpetersyre | NO2- | Nitritt |
| H3PO3 | Fosforsyre | PO33- | Fosfitt |
| HClO2 | Klorsyre | ClO2- | Kloritt |
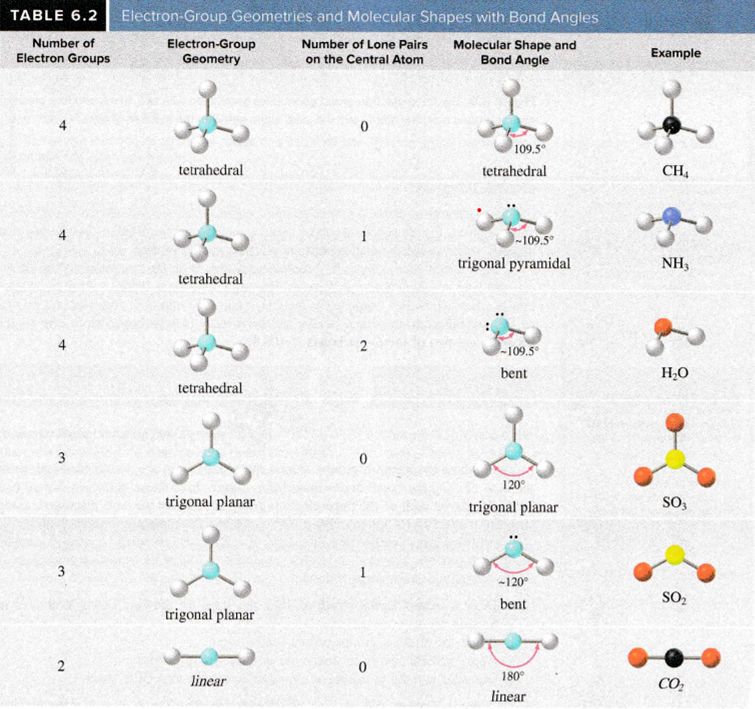
Molekylstruktur


Van der Waals konstanter
| Gass | a | b |
| (atm * L2 / mol2) | (L / mol) | |
| He | 0.034 | 0.0237 |
| Ne | 0.211 | 0.0171 |
| Ar | 1.34 | 0.0322 |
| Kr | 2.32 | 0.0398 |
| Xe | 4.19 | 0.0266 |
| H2 | 0.244 | 0.0266 |
| N2 | 1.39 | 0.0391 |
| O2 | 1.36 | 0.0318 |
| Cl2 | 6.49 | 0.0562 |
| CO2 | 3.59 | 0.0427 |
| CH4 | 2.25 | 0.0428 |
| CCL4 | 20.4 | 0.138 |
| NH3 | 4.17 | 0.0371 |
| H2O | 5.46 | 0.0305 |
Spenningsrekka
| Potensial E oks | Oksidert form | Redusert form | Potensial E red | |
|---|---|---|---|---|
| 3.04 | Li+ + e- | ⇄ | Li | -3.04 |
| 2.92 | K+ + e- | ⇄ | K | -2.92 |
| 2.78 | Ca2+ + 2e- | ⇄ | Ca | -2.78 |
| 2.71 | Na+ + e- | ⇄ | Na | -2.71 |
| 2.36 | Mg2+ + 2e- | ⇄ | Mg | -2.36 |
| 1.66 | Al3+ + 3e- | ⇄ | Al | -1.66 |
| 1.18 | Mn2+ + 2e- | ⇄ | Mn | -1.18 |
| 0.91 | Cr2+ + 2e- | ⇄ | Cr | -0.91 |
| 0.76 | Zn2+ + 2e- | ⇄ | Zn | -0.76 |
| 0.44 | Fe2+ + 2e- | ⇄ | Fe | -0.44 |
| 0.40 | Cd2+ + 2e- | ⇄ | Cd | -0.40 |
| 0.31 | PbSO4 + e- | ⇄ | Pb + HSO4- | -0.31 |
| 0.23 | Ni2+ + 2e- | ⇄ | Ni | -0.23 |
| 0.14 | Sn2+ + 2e- | ⇄ | Sn | -0.14 |
| 0.13 | Pb2+ + 2e- | ⇄ | Pb | -0.13 |
| 0.00 (def.) | 2H+ + 2e- | ⇄ | H2 | 0.00 (def.) |
| -0.34 | Cu2+ + 2e- | ⇄ | Cu | 0.34 |
| -0.40 | O2 + 2H2O + 4e- | ⇄ | 4 OH- | 0.40 |
| -0.80 | Ag+ + e- | ⇄ | Ag | 0.80 |
| -1.36 | Cl2 + 2e- | ⇄ | 2 Cl- | 1.36 |
| -1.50 | Au3+ + 3e- | ⇄ | Au | 1.50 |
| -1.70 | PbO2 + 2H+ + H2SO4 + 2e- | ⇄ | PbSO4 + 2 H2O | 1.70 |
| -2.80 | F2 + 2e- | ⇄ | 2 F- | 2.80 |
